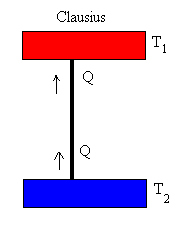
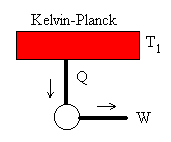
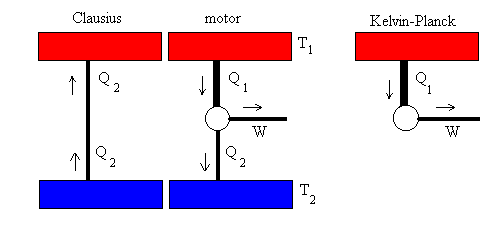
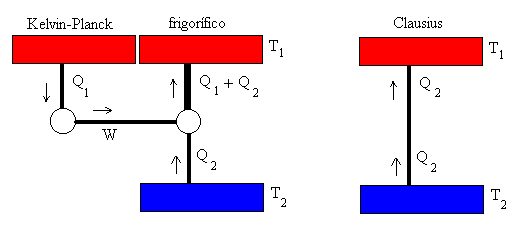
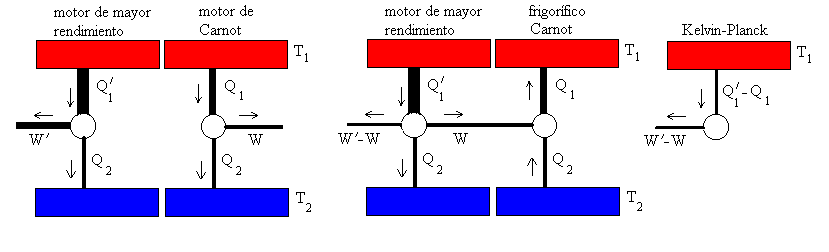
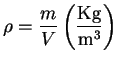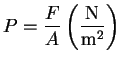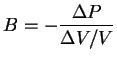Entropía
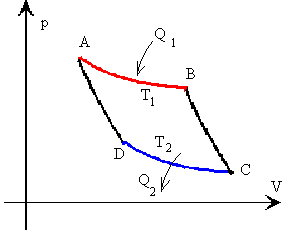 |  |
 | Se puede aproximar un ciclo reversible cualesquiera (en color negro) por una línea discontinua en forma de diente de sierra formada por adiabáticas (color azul) e isotermas (color rojo) tal como se muestra en la figura.Se cumplirá entonces que |
Se define entropía como una función de estado y por lo tanto, la variación de entropía a lo largo de un camino cerrado es 0
Las variaciones de entropía en la transformación 1-2 es
Si la temperatura T es constante, la variación de entropía es el cociente entre el calor y la temperatura.
En un ciclo reversible, la variación de entropía es cero. En todo proceso irreversible la variación de entropía es mayor que cero.
Hemos obtenido una fórmula que nos permite calcular las variaciones de entropía, su interpretación la hemos proporcionado en una simulación de la tendencia hacia el estado de equilibrio de un sistema aislado de partículas interactuantes.
La Segunda ley afirma que la entropía de un sistema aislado nunca puede decrecer. Cuando un sistema aislado alcanza una configuración de máxima entropía, ya no puede experimentar cambios: ha alcanzado el equilibrio.
Variaciones de entropía en procesos irreversibles
Para calcular las variaciones de entropía de un proceso real (irreversible) hemos de recordar que la entropía (como la energía interna) depende solamente del estado del sistema. Una variación de entropía cuando el sistema pasa de un estado A a otro B de equilibrio depende solamente del estado inicial A y del estado final B.
Para calcular la variación de entropía ΔS de un proceso irreversible entre dos estados de equilibrio, imaginamos un proceso reversible entre el estado inicial A y el estado final B y calculamos para este proceso
Como veremos en los ejemplo, la variación de entropía ΔS es siempre positiva para el sistema y sus alrededores en un proceso irreversible.
La entropía de un sistema aislado que experimenta un cambio siempre se incrementa. En un proceso reversible la entropía del sistema aislado permanece constante.
Conducción térmica

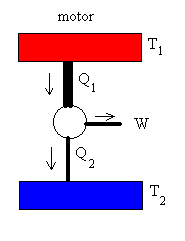
En el proceso de conducción del calor, el sistema está formado por un foco caliente a la temperatura Ta conectado mediante una barra a un foco frío a la temperatura Tb. La barra hecha de un material conductor del calor está perfectamente aislada. Se transfiere a través de la barra una cantidad de calor Q del foco caliente al foco frío. Como el foco frío absorbe calor, su entropía aumenta enQ/Tb. Al mismo tiempo, como el foco caliente pierde calor su variación de entropía es -Q/Ta
Como Ta>Tb, la variación de entropía del sistema formado por la barra y los dos focos es positivo